В традиционной разработке лекарств до 80% патогенных белков в протеоме человека долгое время считались «неизлечимыми» из-за отсутствия стабильных активных сайтов связывания, что создавало непреодолимый барьер в терапии.
Эта проблема решается за счёт разработки таргетных деградаторов белков.
В отличие от традиционной логики, когда ингибиторы малых молекул блокируют патогенную активность, таргетные деградаторы белковнаправлены на удаление патогенных белков из клеток, что открывает новые возможности в таких областях, как онкология и аутоиммунные заболевания.
✨ Благодаря глобальному прогрессу в исследованиях, первая партия деградаторов перешла на поздние стадии клинических испытаний: BGB-16673 и Mezigdomide совершили скачок от подтверждения концепции к клинической практике на основе выдающихся данных.
Dengyue Pharma углубится в изучение таргетные деградаторы белков и двух ведущих препаратов, BGB-16673 и Mezigdomide, чтобы исследовать их огромный потенциал в преодолении лекарственной устойчивости и расширении границ лечения.
Что такое таргетные деградаторы белков?
Таргетные деградаторы белков (TPD) — это класс низкомолекулярных лекарственных препаратов, использующих собственную систему обработки белков клетки для специфической маркировки и удаления патогенных белков.
Их основной механизм представляет собой фундаментальный сдвиг от традиционного функционального ингибирования к физическому удалению.
В настоящее время наиболее развитыми являются два основных технологических направления:
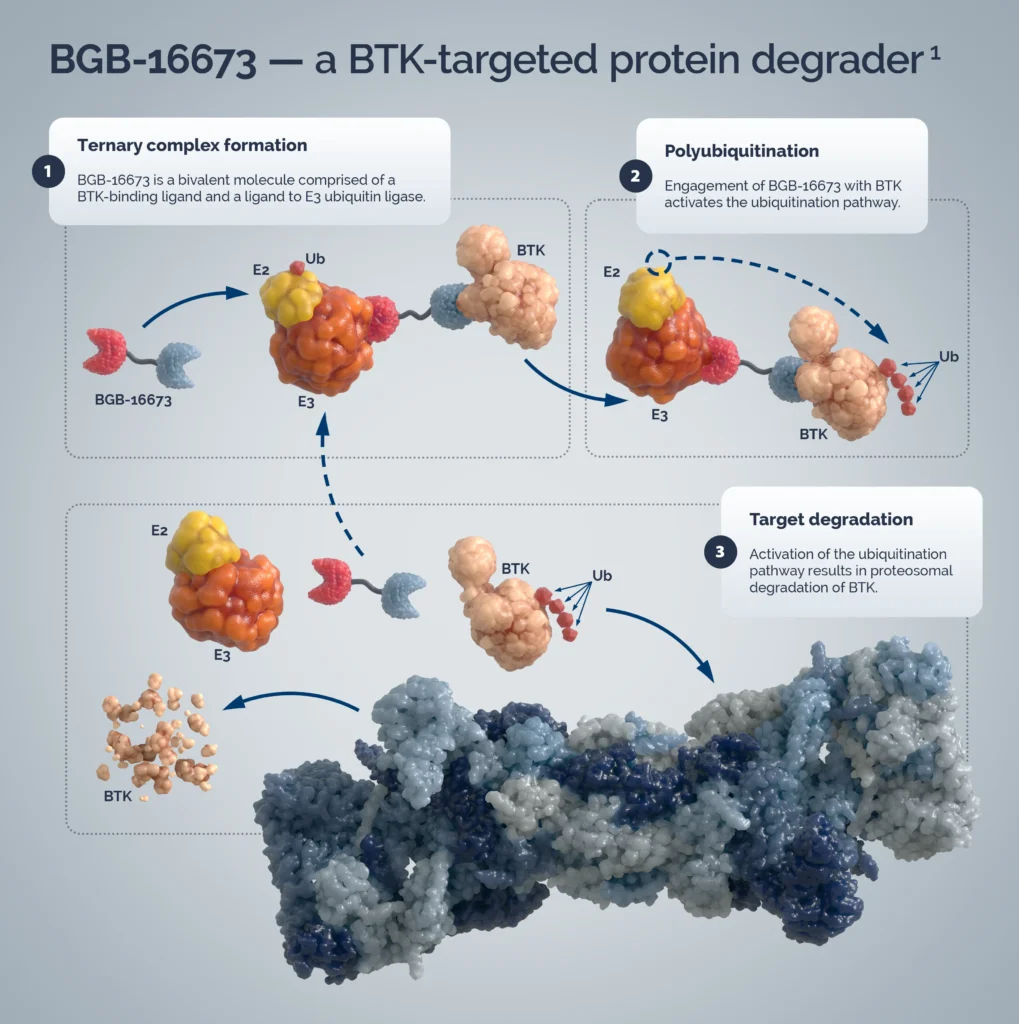
1️⃣ Протеолитическая целевая химера (PROTAC): это бифункциональная молекула, один конец которой присоединен к целевому белку, а другой конец привлекает E3-убиквитинлигазу, вызывая убиквитинирование и маркировку целевого белка, который впоследствии распознается и деградируется протеасомой внутри клетки.
2️⃣Молекулярные клеи (Molecular Glues, MG) : эти молекулы, как правило, меньше и проще по структуре. Вместо прямого соединения двух белков, они связываются с E3-лигазой, изменяя ее поверхностную конформацию и «индуцируя» новое взаимодействие с целевым белком, тем самым инициируя процесс деградации.
По сравнению с традиционными препаратами, стратегия TPD предлагает множество преимуществ:
- Она устраняет функцию целевых белков, избегая лекарственной устойчивости, вызванной мутациями белков или заменой сигнальных путей;
- Ее каталитические свойства означают более низкие дозы и потенциально лучшие безопасные диапазоны;
- Что еще важнее, она открывает совершенно новые возможности разработки лекарств для 80% мишеней, которые ранее были «недоступны».
В настоящее время глобальная научно-исследовательская деятельность в области TPD очень активна, и несколько кандидатов в лекарственные препараты уже находятся на поздних стадиях клинических испытаний.
Среди них препарат PROTAC BGB-16673, нацеленный на BTK, и препарат Mezigdomide, являющийся молекулярным клеем для лечения множественной миеломы, представляют собой переход этой передовой технологии от концепции к зрелому лечению.
BGB-16673: Преодоление дефектов резистентности ингибиторов BTK
BGB-16673 — это перорально вводимое химерное соединение, нацеленное на BTK и индуцирующее его деградацию и подавление сигнальной активности.
1️⃣ Механизм действия BGB-16673
При гематологических злокачественных новообразованиях, таких как B-клеточная лимфома, тирозин-киназа Брутона (BTK) является ключевым узлом в сигнальном пути BCR, и её ингибиторы широко используются.
😢 Однако длительное применение может легко вызывать мутации в таких участках, как C481S в белке BTK, что приводит к неэффективности ковалентных ингибиторов; даже при использовании нековалентных ингибиторов могут возникать новые мутации, приводящие к лекарственной устойчивости.
Прорыв BGB-16673 заключается в том, что он не просто ингибирует активность BTK, а непосредственно разрушает её.
Доклинические исследования подтвердили, что он может эффективно разрушать белки BTK дикого типа и несколько распространенных в клинической практике мутантных белков BTK, включая C481S, T474I и L528W.
2️⃣ Клинические преимущества BGB-16673
Данные исследования I/II фазы, представленные на ежегодной конференции Американского общества гематологии 2024 года:
Результаты исследования фазы I/II продемонстрировали, что объективной частоты ответа (ОРР) в 90% у пациентов с рецидивирующей/рефрактерной макроглобулинемией Вальденстрема и в 78% у пациентов с хроническим лимфоцитарным лейкозом/мелкоклеточной лимфомой.
😊 На основании этих данных препарат получил статус ускоренного рассмотрения (Fast Track) от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для лечения CLL/SLL и перешел к глобальным клиническим испытаниям III фазы.
Разработчик, компания BeiGene, также изучает его применение при аутоиммунных заболеваниях, таких как хроническая спонтанная крапивница, демонстрируя универсальность препарата.
Mezigdomide: препарат второй линии для лечения множественной миеломы
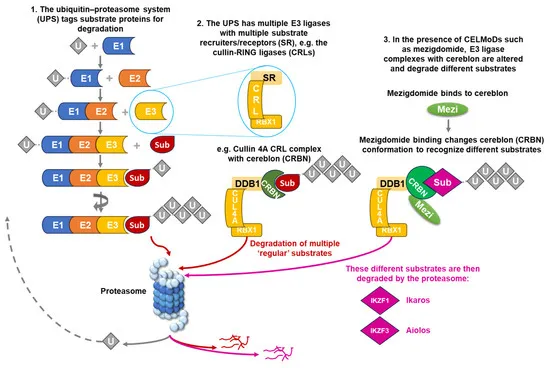
Mezigdomide, модулятор убиквитинлигазы E3 церебролизина, представляет собой новое поколение деградаторов молекулярного клея.
1️⃣ Механизм действия Mezigdomide
🎯 Он индуцирует апоптоз опухолевых клеток, более эффективно способствуя связыванию E3-лигазы с транскрипционными факторами Ikaros и Aiolos, что приводит к быстрой деградации этих двух белков, имеющих решающее значение для выживания клеток миеломы.
😢 У большинства пациентов в конечном итоге развивается резистентность к стандартным методам лечения, таким как леналидомид и помалидомид, что приводит к ограничению последующих вариантов лечения и очень плохому прогнозу.
Прорывная клиническая ценность Mezigdomide заключается в решении ключевой проблемы в лечении множественной миеломы — резистентности к существующим иммуномодулирующим препаратам.
2️⃣ Клинические преимущества Mezigdomide
Клинические исследования показали, что Mezigdomide проявляет значительную активность даже у пациентов, резистентных к леналидомиду, помалидомиду, ингибиторам протеасом и антителам к CD38.
Ключевое исследование I/II фазы, опубликованное в New England Journal of Medicine, подтвердило его прорывную эффективность:
У пациентов с рецидивирующей/рефрактерной множественной миеломой, резистентных ко вышеупомянутым препаратам, объективный ответ на Mezigdomide в комбинации с дексаметазоном оставался на уровне 41%, при этом медиана продолжительности ответа составила 7,6 месяцев.
Mezigdomide, как перспективный препарат-кандидат в разработке компании Bristol-Myers Squibb, предположительно станет улучшенной альтернативой помалидомиду, ориентированной на пациентов, получающих лечение на поздних стадиях и с рефрактерной формой заболевания, и в настоящее время находится на III фазе клинических испытаний.
Заключение: Вызовы и перспективы на будущее
Благодаря прорывам в клинических испытаниях таких препаратов, как BGB-16673 и Mezigdomide, таргетные деградаторы белков быстро превращаются из революционной концепции в жизнеспособный вариант клинического лечения.
| Лекарство | BGB-16673 | Mezigdomide |
| Компании-разработчики | BeiGene | Bristol-Myers Squibb |
| Тип TPD | PROTAC (химерный активатор деградации) | молекулярный деградатор геля |
| Мишень | BTK (дикого типа и мутантный) | деградирует Ikaros/Aiolos через церебролизин |
| Основные преимущества | Преодолевает резистентность к ковалентным/нековалентным ингибиторам BTK | Преодолевает резистентность к существующим иммуномодулирующим препаратам при множественной миеломе |
| Ключевые клинические данные | Демонстрирует высокие показатели ответа (ORR > 78%) у пациентов с рецидивирующим/рефрактерным ХЛЛ/МЛЛ и ВМ | Общая частота ответа достигает 41% у пациентов с множественной миеломой с тройной резистентностью |
| Статус разработки | Проводятся глобальные клинические исследования III фазы | Проводятся глобальные клинические исследования III фазы |
Несмотря на многообещающие перспективы, область TPD по-прежнему сталкивается с рядом проблем на пути к зрелости:
- В медицинской химии высокая молекулярная масса PROTAC может влиять на их пероральную биодоступность;
- с точки зрения безопасности, риск нецелевой деградации и полного блокирования физиологических функций белков требует долгосрочного мониторинга;
- с технической точки зрения, существующие системы в основном нацелены на внутриклеточные белки, и вопрос о том, как деградировать мембранные и внеклеточные белки, остается актуальной темой исследований.
В будущем преодоление этих проблем зависит от непрерывных углубленных глобальных исследований и разработок и сотрудничества в рамках отраслевой экосистемы.
Благодаря постоянному углублению исследований механизмов и технологическим инновациям, ожидается, что TPD станет важной опорой лечения рака следующего поколения, обеспечивая надежную гарантию точного и эффективного лечения заболеваний человека.
DengYuePharma как китайский фармацевтический дистрибьютор, связывает передовые исследования и разработки с потребностями пациентов, предоставить пациентам во всем мире больше вариантов лекарственной терапии.
FAQ относительно таргетные деградаторы белков
Что такое целевой деградатор белков?
Целевой деградатор белков — это лекарственное соединение, которое избирательно связывает патологический белок и запускает его разрушение в клетке через систему убиквитин-протеасомы.
Каким образом происходит деградация белков?
Белки метятся для деградации присоединением убиквитина к остатку лизина, после чего формируется полиубиквитиновая цепь, распознаваемая и расщепляемая протеасомой.
Как работает фермент, разрушающий белки?
Фермент, разрушающий белки, сначала распознаёт и связывает целевой белок, а затем катализирует разрыв пептидных связей или направляет его на убиквитин-протеасомную деградацию, в результате чего белок теряет функцию.
Являются ли целмоды переносчиками белка?
Новая формула CELMoD создана по образцу классической формулы IMiD и имеет химическую структуру, специально разработанную для усиления связывания с цереблоном и деградации целевых белков.
