Миастения гравис (МГ) — хроническое аутоиммунное заболевание нервно-мышечного соединения, от которого во всём мире страдают более 1,2 млн человек, а в Китае — около 220 тысяч пациентов.
😫 Основной патогенетический механизм заболевания заключается в выработке аутоантител, атакующих ключевые белки нервно-мышечного синапса, что нарушает передачу нервных импульсов и приводит к колеблющейся слабости скелетных мышц. Это существенно снижает качество жизни пациентов и в тяжёлых случаях может представлять угрозу для жизни.
С развитием иммунологии и стремительным прогрессом биофармацевтических технологий подходы к лечению МГ претерпели значительные изменения — от простого контроля симптомов к прецизионной иммунной терапии и долгосрочному управлению хроническим заболеванием.
Как фармацевтическая компания, ориентированная на развитие глобальных направлений иммунотерапии, Hongkong DengYue Medicine уделяет особое внимание динамике лечения миастении гравис и другим аутоиммунным заболеваниям, а также инновационным тенденциям в данной области.
Возникает закономерный вопрос: какие лекарства используются при миастении гравис? Как эволюционируют глобальные терапевтические стратегии? Какую роль играет Китай в этой сфере и каких результатов он уже достиг?
В настоящей статье представлен комплексный анализ, основанный на международных эпидемиологических данных, современной клинической практике и инновационных достижениях Китая.
Что такое миастения гравис?
Миастения гравис — это приобретённое аутоиммунное заболевание, опосредованное патологическими аутоантителами. Основной механизм развития заключается в том, что иммунная система аномально вырабатывает антитела, направленные против ацетилхолиновых рецепторов (AChR), мышечно-специфической тирозинкиназы (MuSK) или белка LRP4 в области нервно-мышечного соединения.
Это нарушает передачу нервных импульсов к мышцам и приводит к развитию слабости скелетной мускулатуры.
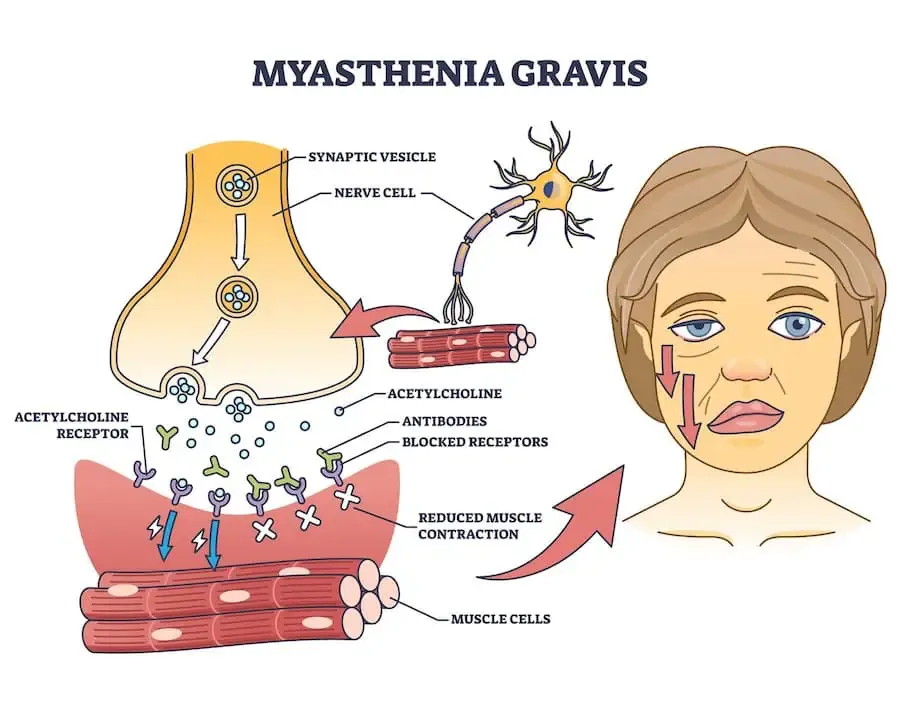
Клиническая картина характеризуется выраженной флуктуирующей мышечной слабостью: симптомы усиливаются после физической нагрузки и частично уменьшаются после отдыха. Данный признак является ключевым дифференциальным критерием МГ по сравнению с другими нейромышечными заболеваниями.
Проявления заболевания могут различаться у пациентов и включают:
- Поражение глазодвигательных мышц: птоз (односторонний или двусторонний), диплопия — начальный симптом примерно у 50% пациентов. У части больных поражение ограничивается только глазными мышцами (глазная форма МГ);
- Поражение конечностей: преимущественно слабость проксимальных отделов (трудности при подъёме рук, расчёсывании волос, подъёме по лестнице); дистальная слабость встречается реже;
- Поражение орофарингеальных мышц: нарушения жевания и глотания, поперхивание при приёме жидкости, назальная речь, дизартрия; в тяжёлых случаях возможно нарушение питания и дыхания;
- Поражение дыхательных мышц: прогрессирующая одышка и дыхательная недостаточность. В тяжёлых случаях развивается миастенический криз — острое угрожающее жизни состояние, требующее неотложной респираторной поддержки и искусственной вентиляции лёгких.
Миастения гравис относится к хроническим прогрессирующим заболеваниям. Большинство пациентов нуждаются в длительной, а нередко и пожизненной медикаментозной терапии и динамическом наблюдении. Стратегия лечения определяется тяжестью заболевания, типом аутоантител, возрастом пациента и наличием сопутствующей патологии.
👉 Понимание патогенеза, клинических проявлений и принципов диагностики МГ является основой для последующего анализа лекарственных стратегий и глобальных тенденций терапии. Далее рассмотрим мировое бремя заболевания и современные потребности в лечении.
Глобальное бремя заболевания и рост потребностей в лечении
В последние годы, на фоне расширения диагностических возможностей (серологическая детекция аутоантител, электромиография, совершенствование визуализации) и прогрессирующего старения населения, глобальная распространённость миастении гравис демонстрирует устойчивую тенденцию к росту.
Традиционно МГ относилась к категории редких заболеваний (распространённость <100 случаев на 1 млн населения).
‼️ Однако согласно современным метаанализам, средневзвешенная глобальная распространённость достигла 173,3 на 1 млн населения (≈17,3 на 100 тыс.), а среднегодовая заболеваемость составляет около 22,9 на 1 млн в год. В отдельных регионах Европы и Северной Америки показатель распространённости превышает 300 на 1 млн, что позволяет рассматривать МГ как значимое хроническое нейроиммунологическое заболевание.
Региональные различия и терапевтические потребности
Эпидемиологические характеристики и структура потребности в терапии существенно варьируют между регионами.
- Европа демонстрирует выраженную географическую неоднородность.
Так, годовая заболеваемость в Норвегии составляет около 0,4 на 100 тыс., тогда как в Италии достигает 2,1 на 100 тыс. Общая распространённость в Европе оценивается приблизительно в 167,9 на 1 млн населения.
Повышение уровня ранней диагностики приводит к увеличению выявляемости лёгких и глазных форм МГ, что смещает акцент системы здравоохранения с «купирования острых состояний» на «долгосрочный контроль заболевания».
- Россия и другие страны постсоветского пространства (включая Казахстан и ряд других государств) характеризуются распространённостью на уровне 100–240 случаев на 1 млн населения, что сопоставимо с глобальными средними показателями.
- В Российской Федерации общее число пациентов оценивается примерно в 14 000–34 000 человек; 60–70% имеют генерализованную форму заболевания, а 15–20% относятся к категории рефрактерных пациентов, не отвечающих на стандартную терапию. Это формирует высокий спрос на современные таргетные и биологические препараты.
- В Украине зарегистрировано около 3 000–4 000 пациентов.
- В Казахстане в период 2017–2019 гг. отмечен рост числа зарегистрированных случаев примерно на 24%.
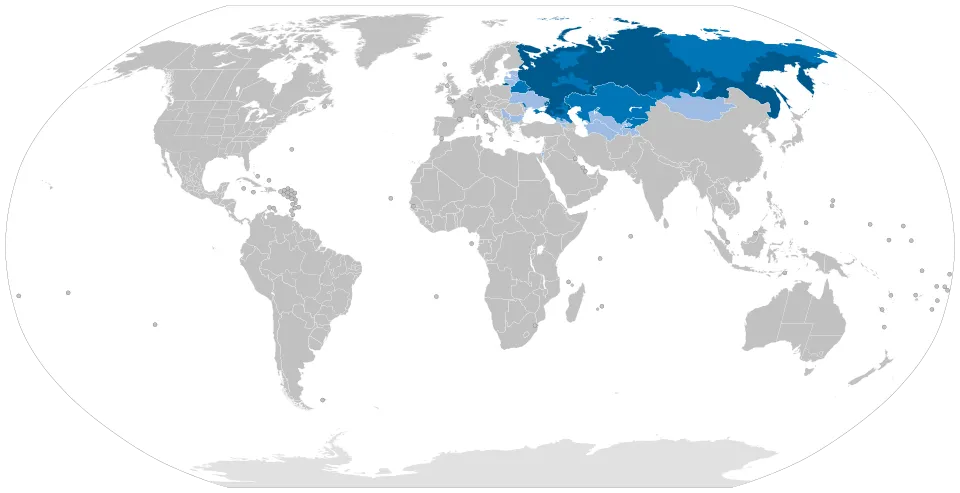
При этом для ряда стран региона характерна неравномерность распределения медицинских ресурсов, что затрудняет доступ пациентов из отдалённых территорий к специализированной помощи и современным схемам лечения.
Старение пациентов и изменение профиля терапии
🧓 Отдельной тенденцией является рост доли пациентов с поздним дебютом МГ (после 50 лет). У данной категории чаще выявляются сопутствующие заболевания (артериальная гипертензия, сахарный диабет, сердечно-сосудистая патология), а переносимость традиционных иммуносупрессоров может быть снижена.
Это дополнительно усиливает потребность в более селективных, безопасных и низкотоксичных таргетных препаратах.
Таким образом, вопрос «какие лекарства используются при миастении гравис» уже выходит за рамки узкоклинической проблематики. Он становится стратегически значимым для фармацевтической индустрии, систем здравоохранения и глобального рынка биотехнологий.
На фоне растущего эпидемиологического бремени далее будет рассмотрена современная терапевтическая архитектура лечения МГ и ключевые препараты, применяемые на разных стадиях заболевания.
Как лечится миастения гравис
Основные цели терапии миастении гравис (МГ) включают два уровня:
- быстрое устранение слабости скелетной мускулатуры для обеспечения повседневной активности и безопасности пациента;
- подавление патологической иммунной реакции с целью замедления прогрессирования заболевания, снижения частоты рецидивов и риска развития кризов.
Современная международная терапевтическая стратегия строится по принципу «поэтапной комбинированной и индивидуализированной терапии». В зависимости от тяжести состояния, клинической формы и типа антител применяется ступенчатая схема лечения:
симптоматическая терапия → иммуносупрессивная терапия → таргетная биологическая терапи.
1️⃣ Симптоматическая терапия (первая линия, базовое лечение)
Симптоматическая терапия является основой лечения МГ. Ее ключевая задача — быстрое облегчение симптомов. Она не влияет на иммунопатологическую основу заболевания и применяется:
- на ранних стадиях,
- при легкой и средней степени тяжести,
- либо в составе комбинированной терапии при более тяжелых формах.
Во всех странах мира данный подход относится к терапии первой линии.
- Ингибиторы ацетилхолинэстеразы (anti-cholinesterase)
Основным представителем является:
👉 Пиридостигмин (Pyridostigmine, бромид пиридостигмина)
Это наиболее широко применяемый препарат симптоматического лечения МГ в мире.
- Начало действия: через 15–30 минут после приема внутрь
- Продолжительность эффекта: 3–6 часов
- Стандартная доза: 60–240 мг/сутки в 3–4 приема
Механизм действия: ингибирование ацетилхолинэстеразы, снижение распада ацетилхолина в нервно-мышечном синапсе, повышение его концентрации и усиление передачи нервного импульса к мышце.
Препарат эффективно уменьшает птоз, слабость конечностей, дисфагию.
Преимущества:
- быстрый эффект
- низкая стоимость
- хорошая переносимость
- более 95% пациентов отмечают улучшение симптомов при начальном применении
Ограничения:
- не подавляет аутоиммунный процесс
- не предотвращает прогрессирование заболевания
- возможны побочные эффекты (диарея, тошнота, гиперсаливация)
- при передозировке возможно развитие холинергического криза
Применение требует строгого соблюдения врачебных рекомендаций.
👉 Неостигмин (Neostigmine)
Механизм аналогичен пиридостигмину, однако:
- начало действия быстрее (5–10 минут)
- продолжительность короче (1–2 часа)
Применяется преимущественно в инъекционной форме:
- при миастеническом кризе
- при невозможности перорального приема
Используется реже, чем пиридостигмин.
Дополнительно калия хлорид и эфедрин могут применяться как вспомогательные средства для усиления эффекта ингибиторов ацетилхолинэстеразы, особенно у пациентов с недостаточным ответом на монотерапию.
Таким образом, симптоматическая терапия является «фундаментом» лечения МГ — она быстро облегчает состояние пациента, но не устраняет иммунологическую причину заболевания. При прогрессировании требуется переход к иммуносупрессивной терапии.
2️⃣ Иммуносупрессивная терапия (контроль основного механизма заболевания)
Если симптоматическая терапия недостаточна либо заболевание принимает генерализованную форму, назначается иммуносупрессивное лечение — ключевой компонент долгосрочного контроля МГ.
Оно направлено на:
- подавление патологической иммунной активности
- снижение продукции аутоантител
- уменьшение риска рецидивов
Международные рекомендации рассматривают иммуносупрессию как стандарт лечения среднетяжелых и тяжелых форм МГ.
Большинство препаратов требуют длительного приема и регулярного контроля функции печени, почек и показателей крови.
- Глюкокортикостероиды
Базовые препараты:
- Преднизон
- Метилпреднизолон (methylprednisolone)
Обладают мощным и быстрым иммуносупрессивным действием. Около 75% пациентов со среднетяжелой и тяжелой формой МГ получают терапию стероидами.
Преднизон — чаще в таблетированной форме с постепенным снижением дозы после стабилизации состояния.Метилпреднизолон — преимущественно для внутривенной «пульс-терапии» при обострениях или угрозе криза.
Длительное применение связано с рисками:
- остеопороз
- гипергликемия
- артериальная гипертензия
- язвенные поражения ЖКТ
- повышенный риск инфекций
Требуется профилактическая и лабораторная поддержка.
- Нестероидные иммуносупрессанты
Часто используются для снижения дозы стероидов или при их непереносимости. Эффект развивается медленно (1–3 месяца), но препараты подходят для длительной терапии.
Основные средства:
- Азатиоприн — наиболее широко применяемый, снижает потребность в стероидах; возможна миелосупрессия и гепатотоксичность
- Микофенолата мофетил — используется при непереносимости азатиоприна; относительно мягкий профиль, возможны ЖКТ-реакции
- Циклоспорин — эффективен при среднетяжелых формах; возможна нефротоксичность и гипертензия
- Такролимус — применяется при рефрактерных формах; возможны гипергликемия и нарушения функции почек
Иммуносупрессивная терапия остается основным долгосрочным инструментом контроля МГ. Однако часть пациентов демонстрирует недостаточный ответ — именно для них разработаны биологические таргетные препараты.
3️⃣ Биологические препараты (таргетная терапия при рефрактерных формах)
Развитие прецизионной медицины привело к внедрению биологических препаратов, направленных на ключевые звенья иммунного ответа. Они особенно важны для пациентов с рефрактерной МГ.
- Анти-CD20 моноклональные антитела (ритуксимаб)
Механизм: элиминация CD20-положительных B-клеток и снижение продукции аутоантител.
Показания:
- AChR-позитивная рефрактерная генерализованная МГ
По данным многоцентровых исследований в России (16 пациентов с рефрактерной формой):
- у 93,75% отмечено снижение титра антител
- у 75% — выраженное клиническое улучшение
Препарат включен во вторую линию терапии во многих странах.
Ограничения: высокая стоимость, риск инфузионных реакций и инфекций.
- Ингибиторы комплемента C5 (экулизумаб)
Блокируют активацию C5 и предотвращают повреждение нервно-мышечного соединения.
Показаны при:
- AChR-позитивной генерализованной МГ
- рефрактерных формах
Обладают быстрым эффектом, однако отличаются высокой стоимостью и неравномерной доступностью в разных странах.
- Ингибиторы FcRn (efgartigimod)
Новое направление терапии.
Механизм: блокирование FcRn-рецептора и ускоренное выведение циркулирующих аутоантител.
Подходят для:
- AChR-позитивных
- MuSK-позитивных
- серопозитивных пациентов
Характеризуются хорошей переносимостью и снижением частоты рецидивов.
В настоящее время также изучаются другие таргетные препараты (анти-CD40, ингибиторы C3 и др.).
Тем не менее, стоимость, сроки регистрации и уровень страхового покрытия существенно различаются между странами. Повышение доступности современных биологических препаратов остается одной из ключевых задач в глобальной стратегии лечения миастении гравис.
Прогресс исследований и инновационный потенциал Китая в области лечения миастении гравис
На фоне стремительного развития глобальных технологий иммунотерапии китайская биофармацевтическая отрасль в последние годы достигла значительных успехов в области антительного инжиниринга и иммунной регуляции, постепенно переходя от модели «догоняющего развития в сегменте дженериков» к формату «параллельного и опережающего развития инновационных препаратов».
В сфере лечения миастении гравис (МГ) прогресс Китая не только приносит пользу примерно 220 тысячам пациентов внутри страны, но и постепенно интегрируется в глобальную инновационную сеть, внося вклад в оптимизацию мировой структуры терапии МГ.
I. Технологическая база Китая в сфере иммунотерапии
В последние годы китайские компании последовательно совершенствуют платформы разработки моноклональных антител, активно развивают биоаналоги и исследуют новые терапевтические мишени, формируя комплексную систему разработки иммунных препаратов, которая создает прочную основу для создания лекарств против аутоиммунных заболеваний, включая МГ.
✅ В сегменте биоаналогов Китай успешно разработал ряд препаратов, связанных с лечением МГ, включая:
- биоаналоги ритуксимаба
- дженерические формы микофенолата мофетила
- пролонгированные формы такролимуса
Эти препараты сопоставимы с оригинальными лекарственными средствами по эффективности и безопасности, при этом их стоимость снижена на 30–50% по сравнению с оригинальными препаратами. Это существенно повысило доступность терапии и позволило большему числу пациентов с МГ в Китае получать стандартизированное лечение.
✅ В области инновационных препаратов китайские компании, опираясь на ключевые механизмы патогенеза МГ, активно исследуют новые терапевтические мишени, сосредотачиваясь на:
- комплементном каскаде
- В-клеточно-опосредованных механизмах
- FcRn-механизме
Несколько кандидатов уже находятся на стадии клинических исследований. В частности, разработанные китайскими компаниями моноклональные антитела против CD20 и ингибиторы FcRn проходят клинические испытания у пациентов с МГ. Предварительные данные показывают сопоставимые показатели эффективности и безопасности с международными аналогами, что создаёт предпосылки для их регистрации в ближайшие годы и расширения спектра инновационных средств лечения МГ на внутреннем рынке.
✅ Одновременно Китай сформировал относительно развитую систему серологической диагностики МГ, включая возможность определения:
- антител к AChR
- антител к MuSK
- антител к LRP4
Точность тестирования соответствует международному уровню и обеспечивает основу для иммунологической стратификации пациентов и разработки персонализированных терапевтических стратегий.
Благодаря определению антительного профиля врач может уточнить патогенетический механизм заболевания и выбрать целевую терапию, избегая нерационального назначения препаратов.
Сформированная технологическая база является важной предпосылкой для участия Китая в глобальной конкуренции в сфере инновационных методов лечения МГ и повышения доступности терапии.
II. Участие в глобальной инновационной конкуренции и интеграция в международную систему
С развитием китайской биофармацевтической отрасли часть отечественных инновационных препаратов постепенно выходит на международный уровень, участвуя в глобальных многоцентровых клинических исследованиях и интегрируясь в международные системы регистрации лекарственных средств (такие как FDA и EMA), способствуя выходу китайских разработок на мировой рынок.
Например, новый анти-CD20 моноклональный препарат, разработанный китайской компанией, проходит многоцентровые клинические исследования в различных странах и регионах, включая Китай, Европу, Северную Америку и Юго-Восточную Азию. Полученные данные планируется использовать для глобальной регистрации препарата, что потенциально расширит терапевтические возможности для пациентов с МГ по всему миру.
Кроме того, китайские фармацевтические компании активно сотрудничают с зарубежными научными институтами и клиническими центрами, совместно изучая механизмы патогенеза МГ и разрабатывая новые терапевтические стратегии, а также участвуя в международных экспертных обсуждениях и разработке клинических рекомендаций в области нейроиммунологии.
Модель «локальная разработка + международное сотрудничество» ускоряет развитие инновационных препаратов для лечения МГ и способствует интеграции Китая в глобальную систему иммунотерапевтических инноваций.
🐉 Как крупнейшая развивающаяся страна мира, Китай обладает развитой системой производства биофармацевтической продукции и эффективными механизмами контроля затрат, что обеспечивает значительные преимущества в масштабировании производства препаратов для лечения МГ.
🌐 В глобальном контексте сочетание инновационного потенциала и масштабируемого производства создаёт предпосылки для расширения доступа к терапии в развивающихся странах и регионах с ограниченными медицинскими ресурсами, включая ряд русскоязычных стран и государств Юго-Восточной Азии.
Это может способствовать улучшению ситуации с ограниченной доступностью современных биологических препаратов и позволить большему числу пациентов с МГ получать стандартизированное и эффективное лечение.
Заключение: Ключ — в поэтапной комбинированной терапии
Возвращаясь к основному вопросу статьи — какие лекарства используются при миастении гравис, — важно подчеркнуть:
речь идёт не об одном конкретном препарате, а о системной модели лечения, основанной на принципах поэтапности, индивидуализации и долгосрочного контроля заболевания.Современная терапевтическая структура включает:
- Симптоматическую терапию (ингибиторы ацетилхолинэстеразы);
- Иммуносупрессивную терапию (глюкокортикоиды и базисные иммуномодулирующие препараты);
- Таргетную биологическую терапию (селективные иммунные мишени);
- При необходимости — лечение миастенического криза и тимэктомию.
- У пациентов с лёгким течением акцент делается на симптоматическом контроле.
- При генерализованных и среднетяжёлых формах приоритетом становится иммуномодуляция.
- У рефрактерных пациентов ключевую роль играют современные таргетные биологические препараты.
Таким образом, терапевтическая логика строится не вокруг выбора одного лекарства, а вокруг ступенчатой стратегии усиления терапии в зависимости от клинической динамики и иммунологического профиля пациента.С развитием прецизионной иммунологии лечение МГ постепенно трансформируется — от преимущественного контроля симптомов к модели селективного иммунного регулирования и долгосрочного управления хроническим заболеванием.
На фоне эволюции глобальной прецизионной терапии Dengyue Medicine, как международная платформа фармацевтической дистрибуции, интегрируется в мировую систему лекарственного обращения, способствуя расширению законного и регулируемого доступа к современным инновационным препаратам.
В конечном итоге, при выборе терапии миастении гравис решающим является не вопрос «какой препарат назначить», а научно обоснованная поэтапная комбинация средств, обеспечивающая безопасность, эффективность и устойчивый контроль заболевания.👉 С дальнейшим развитием глобальных инноваций МГ всё более воспринимается как хроническое заболевание, поддающееся контролю и управляемому лечению.
FAQ относительно того, какие лекарства используются при миастении гравис
Какие лекарства используются для лечения миастении гравис?
К таким лекарствам могут относиться азатиоприн (Азасан, Имуран), микофенолат мофетил (Целлсепт), циклоспорин (Сандиммун, Генграф и др.), метотрексат (Трексалл) или такролимус (Астаграф XL, Програф и др.).
Эти лекарства, действие которых может начаться через несколько месяцев, могут применяться в сочетании с кортикостероидами.
Что нового в лечении миастении?
Эфгартигимод – препарат, разработанный для лечения генерализованной формы миастении, механизм действия которого основан на блокировании рецептора Fc, что приводит к снижению уровня аутоантител (IgG) к ацетилхолиновому рецептору.
Применяется ли преднизолон при миастении гравис?
Преднизон — проверенное средство лечения миастении гравис , — сказал Камински.
Он недорогой, широко доступный и обычно начинает действовать через четыре-шесть недель.
Но стероиды имеют побочные эффекты, включая увеличение веса, отек лица и изменения настроения.
Какие лекарства могут усугубить миастению гравис?
Некоторые лекарственные препараты, такие как ингибиторы иммунных контрольных точек и статины , могут вызывать аутоиммунные реакции, которые могут провоцировать или усугублять миастению гравис (МГ).
Другие лекарственные препараты, такие как аминогликозиды, антимускариновые средства, нервно-мышечные блокаторы и бензодиазепины, влияют на нервно-мышечную передачу и могут усугублять МГ.
